在研乙肝新药进入抑制剂贺普拉肽获批进入Phase II/III期临床
据来自国家药品监督管理局药品评审中心网站的消息,上海贺普药业股份有限公司研发的First-in-class在研乙肝新药贺普拉肽(Hepalatide)已经获得NMPA临床试验默认许可,将进入Phase II/III期临床研发阶段。
“全国现有的5000多家制药企业尚无一家进入世界制药50强。即便是从仿制药的角度来看,中国医药企业距离以色列Teva、德国Sandoz等仿制药巨头也有相当大的距离。”在近日企业采访中,上海贺普生物科技有限公司总经理刘宏利博士对此忧心忡忡。我国目前每年审批的药品中,90%是剂型改造和仿制药,究其原因主要在于创新药物研发投入大、研发周期长,广大药企或望而却步,或不愿为此冒险。而在仅有的一成创新药物研发企业中,部分企业又由于没有从市场需求出发,品种研发过程没有形成资本化商业发展模式,导致大部分创新品种无法有效产业化而最终夭折。
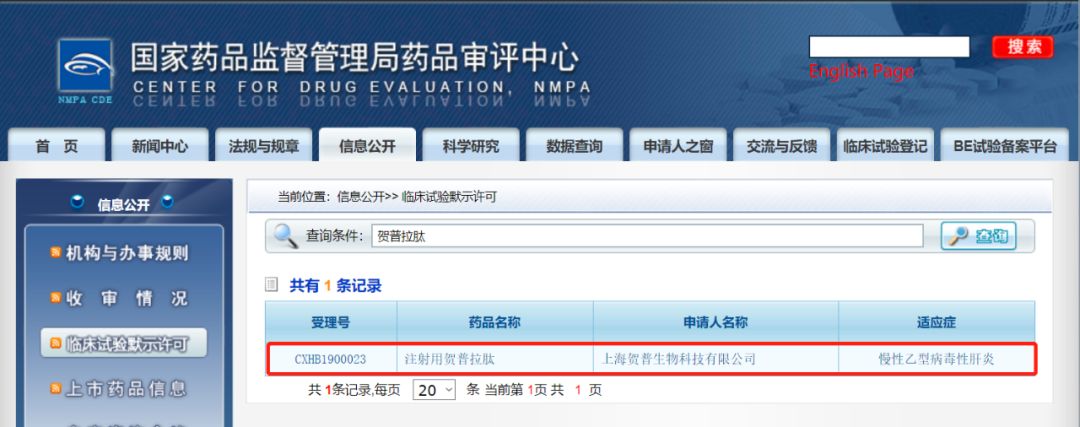
贺普拉肽(Hepalatide)是一款进入抑制剂,通过与HBV肝细胞感染受体NTCP结合,阻断HBV感染,打断现有乙肝治疗中病毒清除→再感染的绵长循环。使健康肝细胞逐渐完成对HBV受染肝细胞的替换,进而提高慢性乙肝的治疗效率,甚至有可能使慢性乙肝获得完全治愈。
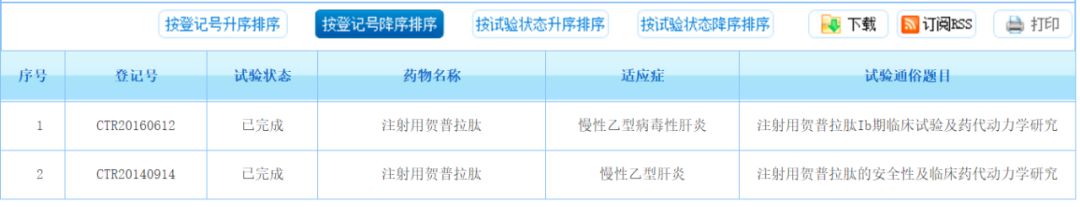
贺普拉肽(Hepalatide)已于2014年11月取得了化学药品第1.1类药物临床试验批件,并且在北京302医院已完成Phase I 期临床研究。
在此前的苏州举办的第二届中国医药创新投资大会上,上海贺普药业股份有限公司CEO刘宏利对贺普拉肽的临床研究数据进行首次公布。
贺普拉肽体内阻断HBV感染评价显示,高、中剂量组治疗9天后HBV DNA(拷贝/ml)水平均降至检测限以下,高、中、低剂量组治疗21天血清ALT(IU/ml)水平均降至检测限以下。药代研究显示贺普拉肽具有显著的肝靶向性。
注射用贺普拉肽随机、双盲、空白对照剂量递增I期临床试验,针对单纯抗HBV Pre-S1抗体阳性患者,按4:1双盲、随机进入试验和对照组。Phase Ia入组患者45例,Phase Ib入组患者35例。临床试验结果显示,药物安全性优异,获得了临床推荐剂量并验证了胆汁酸升高(TBA)呈剂量依赖关系。
即将启动的Phase II/III期临床研究以停药后持续病毒学应答为主要研究终点,解放军总医院第五医学中心王福生院士担任临床试验首要研究者。公司预计于2022年完成Phase III期临床研究后申请新药上市。
贺普拉肽药物基础结构是贺普药业研发团队依据我国流行的C基因型HBV Pre-S1设计的,其专利申请早于国际上同样源于C基因型HBV Pre-S1氨基酸序列的MyrcludexB,属于HBV病毒进入抑制剂first-in-class原研新药。
2018年国家药品监督管理局(NMPA)在全球率先发布了《慢性乙型肝炎抗病毒治疗药物临床试验技术指导原则》,确定了以持续病毒学应答和表面抗原阴转为核心的临床研究终点,对乙肝创新药物的临床研发予以及时的规范和指导。
2012年11月钠-胆酸转运蛋白NTCP被我国科学家李文辉博士确定为HBV感染受体,该成果为乙肝研究领域关键性里程碑。乙肝感染受体NTCP的确定,根本性地推动了乙肝感染机制的深刻认识,将为乙肝的防治做出巨大贡献。
贺普拉肽Phase II/III期临床研究已获国家“重大新药创制”科技重大专项项目支持。(更多肝病新药研究信息敬请关注“肝脏时间”微信公众号)!
 地址:上海市浦东新区半夏路100弄23号楼
地址:上海市浦东新区半夏路100弄23号楼 电话:021-68412368
电话:021-68412368 E-mail:xiongchunfang@heppharma.com
E-mail:xiongchunfang@heppharma.com